Лекция
2 ОСНОВНЫЕ СВОЙСТВА ПРИРОДНЫХ ГАЗОВ
2.1 Состав и классификация
природных газов
Природные газы, добываемые из чисто газовых, нефтяных и газоконденсатных месторождений,
состоят из углеводородов гомологического
ряда метана с общей формулой СnН2n+2. а также
неуглеводородных компонентов: азота (N2),
углекислого газа (СО2), сероводорода (H2S), благородных
(инертных) газов (гелия, аргона, криптона, ксенона), ртути.
Число углеродных атомов в
молекуле углеводородов п может достигать 17—40.
Метан (СН4), этан (С2Н6) и этилен (С2Н4)
при нормальных условиях (р= 0,1 МПа и Т = 273 К)
являются реальными газами.
Пропан (С3Н8), пропилен (С3Н6),
изобутан (i-C4H10), нормальный бутан (п-С4Н10)
бутилены (С4Н8) при атмосферных условиях находятся в
парообразном (газообразном) состоянии, при повышенных давлениях—в жидком состоянии. Они входят в состав жидких (сжиженных)
углеводородных газов.
Углеводороды, начиная с изопентана (i-C5H12), при
атмосферных условиях находятся в жидком состоянии. Они входят в состав бензиновой
фракции. Их называют углеводородным конденсатом. Углеводороды,
в молекулу которых входит 18 и более атомов углерода (от С18Н38),
расположенных в одну цепочку, при атмосферных условиях находятся в твердом состоянии.
Природные газы классифицируют по
трем группам:
1) Газы, добываемые из чисто газовых месторождений.
2)
Газы,
добываемые вместе с нефтью (попутные газы).
3) Газы, добываемые из газоконденсатных
месторождений.
Газовыми и
газоконденсатными месторождениями являются месторождения, которые находятся в
пластовых условиях в однофазном состоянии.
Нефтяными
являются залежи, в которых объем нефтяной части залежи больше объема газовой
шапки и составляет более 0,75. Газонефтяные
0,5-0,75. Нефтегазовые
или нефтегазоконденсатные (НГКМ), в которых объем нефтяной части 0,25-0,5. В газовых
и газоконденсатных месторождениях
содержание метана обычно превышает 90%, тогда как в газонефтяных находится в
пределах 50%.
Сухой газ состоит преимущественно из метана. Жирный газ
содержит в своем составе более тяжелые компоненты, характерен для попутных
нефтяных газов. Искусственными газами называют газы, полученные при сухой перегонке
твердых топлив (каменный уголь, горючий сланец).
2.2
Основные свойства природных газов
2.2.1 Плотность газа r0 в нормальных
физических условиях (Р0-0,1013 МПа и Т0=273
К) можно определить по формуле:
![]() , (2.1)
, (2.1)
где М - молекулярная масса.
Если задана плотность газа при
нормальных условиях (н.у.), можно определить относительную плотность газа, как
отношение плотности газа к плотности воздуха (плотность воздуха при н.у. равна
1,293 кг/м3):
![]() . (2.2)
. (2.2)
Коммерческие расчеты в газовой промышленности проводят
при стандартных условиях (Рст=0,1013 МПа, Тст=293
К). В некоторых странах, в т. ч. в США Тст принята равной 288 К (15°С).
Природные газы представляют собой смесь компонентов,
поэтому если известен молярный состав смеси в процентах, то среднюю
молекулярную массу вычисляют по формуле:
![]() (2.3)
(2.3)
где
у1, у2,…,уn-молярные (объемные) доли компонентов, %; М1,
М2,…, Мn-молекулярные
массы компонентов.
Плотность
природного газа при заданном давлении и
температуре определяется по формуле: ![]() , (2.4)
, (2.4)
где
r0 - плотность газа при нормальных условиях –н.у. (Р0=0,1013 МПа; Т0=273 К); z0, z-коэффициенты сверхсжимаемости при н.у. и при заданных
условиях. Коэффициент
сверхсжимаемости характеризует отклонение реального газа от законов идеального
газа. При н.у. z0![]() 1.
1.
2.2.2 Плотность углеводородного конденсата
Если дан массовый или молярный состав газа, то
содержание в нем тяжелых углеводородов
(пропановой фракции, бутановой фракции и газового бензина) определяется
по формуле: А=
где g –массовое содержание
данного тяжелого углеводорода в газе, %; rсм – средняя плотность природного газа (смеси газов),
кг/м3; у – молярное содержание данного тяжелого компонента в газе; r - плотность данного тяжелого компонента, кг/м3.
Считают, что в газовый бензин целиком переходит пентан плюс вышекипящие и часть нормального бутана.
Средняя плотность жидкой смеси
определяется по формуле:
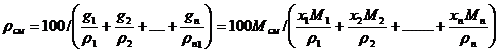 , (2.6)
, (2.6)
где g- массовое содержание компонентов жидкой смеси, %; М – молекулярные
массы компонентов; r - плотности компонентов жидкой смеси, кг/м3.
2.2.3 Вязкость природного газа
Коэффициент динамической вязкости природных газов при
атмосферном давлении и различных температурах можно рассчитать по формуле:
m0=mРат,t=0,0101t1/8-1,07×10-3Мсм1/2
(2.7)
где t-температура в °С,
или m0=0,0101t1/8-5,76×10-3rсм1/2 (2.8)
В
интервалах 12![]() Мсм
Мсм![]() 100 и 10
100 и 10![]() t
t![]() 204°С
погрешность расчета по формулам (2.7) и (2.8) не превышает 5 %.
204°С
погрешность расчета по формулам (2.7) и (2.8) не превышает 5 %.
По номограмме С. Г. Ибрагимова порядок определения вязкости следующий:
![]() см®Ркр®Рпр®
см®Ркр®Рпр®![]() см ®rпр®m.
см ®rпр®m.
При
наличии в природном газе >5% азота учитывают его вязкость
mсм=yama+(1-уa)my, (2.9)
где ma, my–коэффициенты динамической вязкости азота и
углеводородной части смеси газов; ya–молярная доля азота в смеси.
2.2.4
Тепловые свойства природных газов
Теплоемкость природного газа
Удельной теплоемкостью называется количество
теплоты, которое необходимо подвести к единице массы вещества, чтобы изменить
его температуру на 1 градус.
Для
газов различают удельные теплоемкости: изобарную ср (р=const) и
изохорную сv (v=const)
Изобарная молярная теплоемкость природных
газов определяется по формуле:
ср0=0,523(8,36+0,00892t)Мi3/4, ![]() (2.10)
(2.10)
где t-температура, °С; Мi-молекулярная масса I-го компонента природного газа.
Тогда
для смеси газов формула (17) преобразуется следующим образом:
![]() ,
, ![]() (2.11)
(2.11)
где yi-молярная
доля I-го компонента в смеси, срi-изобарная молярная
теплоемкость I-го компонента.
Изобарная молярная теплоемкость реальных природных
газов зависит от давления и от температуры ср=ср0(t)+Dcp (P,t),
(2.12)
где Dcp (P,t)-изотермическая
поправка теплоемкости на давление, ее можно определить по номограмме в зависимости
от приведенных параметров.
Для
приближенных расчетов при 0,02≤Рпр≤4, 1,3≤Тпр≤2,5
Dc0=32,600Рпр/Тпр4
кДж/(кмоль∙К) (2.13)
Теплоемкость неуглеводородных компонентов (N2, H2S и СО2) примерно
равна 0,5 теплоемкости углеводорода с одинаковой молярной массой.
Теплотоворная способность или теплота сгорания – количество тепла, выделяемое при сгорании при
определенных условиях (чаще всего при Р=0,013 МПа и Т=288К).
Единицы измерения - МДж/кг, МДж/м3 (ккал/кг, ккал/м3). Различают
высшую и низшую теплоту сгорания. Для получения низшей теплоты сгорания из
высшей вычитают тепло, расходуемое на испарение гигроскопической воды.
Присутствие в смеси инертных газов
понижает теплоту сгорания. При сгорании 1кг каменного угля выделяется 9
ккал, 1кг нефти – 11 ккал, 1м3 газа
- 7 ккал.
Дросселирование –
расширение газа при прохождении через дроссель — местное гидравлическое сопротивление (вентиль, кран,
сужение трубопровода и т.д.), сопровождающееся изменением температуры.
Дросселирование – термодинамический процесс, характеризующийся постоянством
энтальпии (i = const). В процессе дросселирования реального
природного газа при его движении через штуцер, задвижку, регулятор давления,
клапан-отсекатель, колонны труб в скважине, неплотности в оборудовании
промыслов уменьшается температура газа.
Изменение температуры газов и жидкостей
при изоэнтальпийном расширении называется эффектом Джоуля-Томсона или дроссель-эффектом, а Di часто называют коэффициентом Джоуля-Томсона.
Di = (¶Т/¶р)i = [T
(¶V/¶Т)p – V]/сp, или Di = DТ/ DР,
(2.14)
где DТ – изменение температуры, а DР- изменение давления. Среднее
значение коэффициента Джоуля—Томсона для природного газа изменяется от 2 до 4 К/МПа в зависимости от состава газа, падения
давления и начальной температуры газа. Для приближенных расчетов среднее
значение коэффициента Джоуля—Томсона можно принимать равным 3
К/МПа. У жидкостей Di, <;0, поэтому при дросселировании они нагреваются.
Для наибольшего снижения температуры газа в штуцере необходимо удалять жидкость
из газового потока до его поступления в штуцер.Среднее
значение коэффициента Джоуля—Томсона для нефти изменяется от 0,4 до 0,6 К/МПа,
для воды оно составляет 0,235 К/МПа.
2.2.5
Опасные свойства природного газа
Токсичность
С увеличением молекулярной массы предельных углеводородов
их токсические свойства возрастают. Санитарными нормами проектирования
промышленных предприятий предусмотрена в рабочей зоне производственных
помещений предельно допустимая концентрация углеводородов (паров бензина),
равная 0,3 мг/дм3. Из газовых компонентов природных и нефтяных газов особенно
токсичен сероводород. Сероводород
— бесцветный газ.
Относительная плотность его по воздуху 1,19. Человек чувствует сероводород
(запах тухлых яиц) даже при содержании его в воздухе 0,0014—0,0023 мг/дм3.
Однако даже при непродолжительном пребывании человека в сероводородной среде
его обоняние притупляется. Сероводород является ядом, вызывающим паралич
органов дыхания и сердца. Предельно допустимая концентрация сероводорода в
рабочей зоне производственных помещений —0,01 мг/дм3. Углекислый газ —
бесцветный, практически без запаха. Общий характер действия на организм —
наркотический и раздражающий кожу и слизистые оболочки. В высоких концентрациях
вызывает быстрое удушье вследствие недостатка кислорода. При содержании 4—5%
углекислого газа в воздухе у человека раздражается слизистая оболочка
дыхательных путей и глаз, появляются кашель, головокружение, повышается кровяное
давление. При вдыхании весьма высоких концентраций углекислого газа наступает
смерть от остановки дыхания (при 20% газа в воздухе смерть наступает через
несколько секунд).
Способность к образованию взрывоопасных смесей
Природные углеводородные газы образуют взрывоопасные
смеси с воздухом. Для
каждых данных условий существуют два предела взрываемости газовоздушных смесей:
1) нижний предел соответствует минимальной концентрации
горючего газа, при которой горение еще возможно;
2) верхний предел соответствует максимуму этой
концентрации.
С повышением давления смеси значительно возрастают пределы
ее взрываемости. Горение и взрыв — однотипные химические процессы, но резко
отличающиеся по интенсивности протекающей реакции. При взрыве реакция
происходит очень быстро в замкнутом пространстве без доступа воздуха к очагу
воспламенения взрывоопасной газовоздушной смеси. Скорость распространения
детонационной волны горения при взрыве (900—3000 м/с) в несколько раз превышает
скорость звука в воздухе при комнатной температуре. Сила взрыва максимальна,
когда содержание воздуха в смеси становится теоретически необходимым для
полного сгорания. При концентрации газа в воздухе в пределах воспламенения и
при наличии источника воспламенения произойдет взрыв; если же
содержание газа в
воздухе меньше нижнего
и больше верхнего пределов воспламенения, то смесь не способна
взорваться.
2.3 Уравнения
состояния реальных газов
Обобщенный закон Клайперона – Менделеева – уравнение
состояния идеальных газов.
PV = mRT, (2.16)
где
Р- абсолютное давление6 давление, Па; V – объем, м3; m –масса газа, кг; Т – абсолютная температура,
К; R – универсальная газовая постоянная, Дж/ кг ×К , ( 8314,3
Дж/моль×К).
Для идеального
газа отношение PV/ mRT =z =1, или для единицы
массы PV=zRT, где z – коэффициент
сверхсжимаемости реального газа, характеризующий отклонение газа от идеального, т.е. чем больше
отклонение от идеального газа, тем больше z отлично от 1.
Прогресс науки и техники потребовал разработки более
точного уравнения состояния природных газов, способного правильно описывать
изменение их свойств при давлениях до 100 МПа и температурах до 573 К в процессах добычи газа и при давлениях до 20 МПа и
низких температурах (до 93 К) в процессах переработки природных газов.
В решении этой
проблемы выявились два направления:
-
добавление в
уравнение состояния идеального газа большего числа констант.
-
введение
поправочного коэффициента z, учитывающего
отклонение реального газа от идеального, в уравнении состояния идеального газа
(коэффициента сверхсжимаемости).
Уравнение
Ван-дер-Ваальса
В 1879г. голландский физик Ван-дер-Ваальс предложил
учесть силы взаимодействия и объем
молекул следующим образом:
![]() , (2.17)
, (2.17)
где ![]() - константа сцепления
молекул, Па; v =V/ m - удельный объем газа, м3/ кг; b - поправка
на собственный объем молекул (при шарообразных молекулах это учетверенный объем
молекул,
- константа сцепления
молекул, Па; v =V/ m - удельный объем газа, м3/ кг; b - поправка
на собственный объем молекул (при шарообразных молекулах это учетверенный объем
молекул, ![]() выражает внутреннее
давление (равнодействующая сил притяжения всех молекул объема V).
выражает внутреннее
давление (равнодействующая сил притяжения всех молекул объема V). 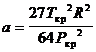 ;
; ![]() . (2.18)
. (2.18)
Уравнение состояния Ван-дер-Ваальса довольно точно описывает изменение свойств
реальных газов при давлениях до 10 МПа и температурах от 283 до 293 К.
Коэффициент сверхсжимаемости
природных газов
Коэффициент
сверхсжимаемости учитывает отклонение свойств реального газа от
идеального. В уравнении Клайперона – Менделеева
PV=zRT для
идеального газа z=1.
При определении коэффициента сверхсжимаемости
используются понятия «приведенные и критические параметры газа»
Ткр - критическая
температура чистого вещества это максимальная температура, при которой жидкая и
паровая фазы могут существовать в равновесии или та температура
при которой средняя молекулярная кинетическая энергия становится равной потенциальной энергии
притяжения молекул. Выше этой температуры газ ни при каком давлении не может перейти в жидкость. Давление паров вещества при критической температуре
называется критическим давлением (Рк )
Для смеси газов вводится понятие псевдокритических (или
среднекритических параметров) Ркр.см = Sуi Р
кр i ; Т кр.см = Sу i Ткрi, где у–i молярная доля i-го компонента в смеси газов; Ркр.i, Ткр.i–критическое давление и критическая температура i-го компонента, n–число компонентов смеси.
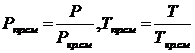 (2.19)
(2.19)
Если
состав газоконденсатной смеси неизвестен, а измерена ее относительная
плотность по воздуху 0,56£![]() £1, то псевдокритические параметры определяют по
формулам:
£1, то псевдокритические параметры определяют по
формулам:
Ркр=0,1(55,3-10,4![]() 1/2 ), (2.20)
1/2 ), (2.20)
Ткр=12+238![]() 1/2. (2.21)
1/2. (2.21)
Д.Браун и Д.Катц установили зависимость z от приведенного давления и приведенной температуры ( Рпр и Тпр) и построили
графики для нахождения
коэффициента сверхсжимаемости z .
Этот метод является одним из наиболее
распространенных методов определения коэффициента сверхсжимаемости. При наличии неуглеводородных компонентов
(N2, H2S, CO2) следует
вводить поправку z=yaza+(1-уa)zy, где za, zy–коэффициенты сверхсжимаемости азота и углеводородной
части смеси газов; ya–молярная доля азота
в смеси.
Осн: 1[12-16,20-43], 2[3-15]
Доп: 9[9-21], 11[4-14], 16[27-33].
Контрольные вопросы:
1. Охарактеризуйте состав природных газов
2. Классификация
природных газов.
3. Виды вязкости природных газов
4. Относительная плотность природного газа.
5. Какие тепловые
свойства природных газов Вы знаете?
6. Как происходит дросселирование природных газов?
7. Опасные свойства природного газа
8. Критические и приведенные параметры многокомпонентных
смесей.
9. Напишите уравнения состояния реальных газов
Клайперона-Менделеева и Ван–дер- Ваальса.
10.
Что характеризует
коэффициент сверхсжимаемости природных газов?